We kunnen natuurkundige systemen op verschillende niveaus bestuderen: op het allerkleinste, microscopische niveau, of op het macroscopische niveau dat we in ons dagelijks leven ervaren.
Denk als voorbeeld aan het leeglopen van een gasfles. Op het microscopische niveau kunnen we dat proces beschrijven door op elk moment van elk gasatoom de plaats en de snelheid vast te leggen. Op het macroscopische niveau zijn we niet geïnteresseerd in al deze details voor de individuele atomen, maar alleen in bijvoorbeeld de gasdruk in de gasfles, de temperatuur van het gas, de hoeveelheid gas die al naar buiten is gestroomd, enzovoort.
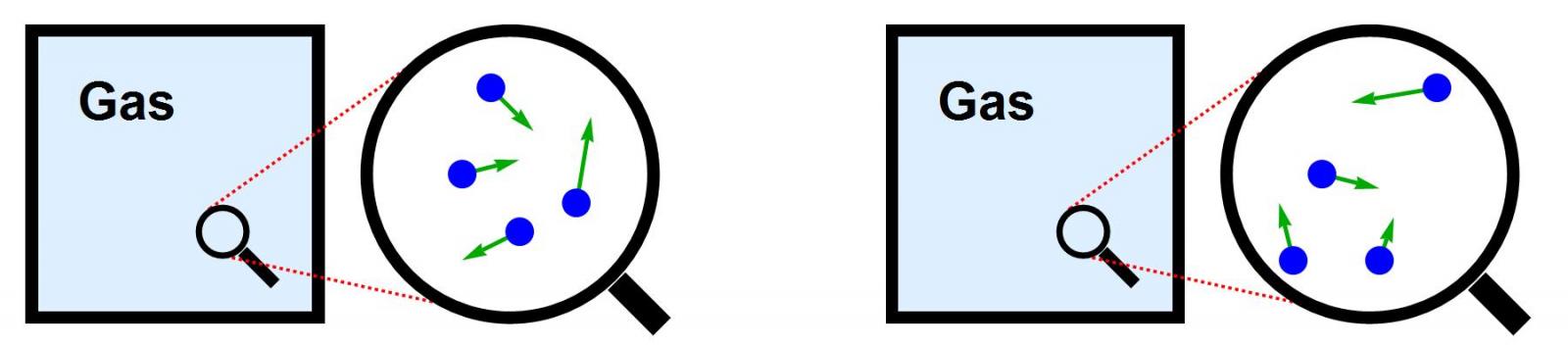
Afbeelding 1. Een gasEen macroscopisch gas met een bepaalde gasdruk en temperatuur kan op microscopische schaal op heel veel verschillende manieren zijn opgebouwd.
In een praktische, macroscopische beschrijving van een systeem, laten we dus heel veel informatie achterwege. Entropie is een maat voor deze hoeveelheid onbekende informatie. Iets preciezer: met één bepaalde macroscopische situatie – een bepaalde druk, temperatuur, enzovoort – zullen in het algemeen heel veel verschillende microscopische situaties overeenkomen. De entropie van een macroscopische toestand is een maat voor hoeveel verschillende microscopische toestanden overeenkomen met die macroscopische toestand.
Entropie is daarmee ook een maat voor waarschijnlijkheid. Als we de kraan van een gasfles opendraaien, kunnen de gasatomen vrij naar buiten én weer naar binnen vliegen. Het is dus strikt genomen niet onmogelijk dat na verloop van tijd alle gasatomen spontaan de gasfles weer in vliegen. Die situatie is alleen zo onwaarschijnlijk dat we zoiets in de praktijk nooit zien gebeuren. In termen van microscopische toestanden: de hoeveelheid mogelijke microscopische toestanden waarbij alle atomen zich in de gasfles bevinden, is zoveel kleiner dan de hoeveelheid microscopische toestanden waarbij een groot deel van de atomen zich buiten de gasfles bevindt, dat de fles in de praktijk nooit zal volstromen. In termen van entropie: de entropie van de toestand “alle atomen in de gasfles” is extreem veel kleiner dan de entropie van de toestand “vrijwel alle atomen buiten de gasfles”.
Als we zo nog een stapje verder redeneren, ontdekken we een belangrijke wet uit de natuurkunde: entropie zal in de praktijk in de loop van de tijd alleen maar toenemen. Deze wet wordt de Tweede Hoofdwet van de Thermodynamica genoemd.
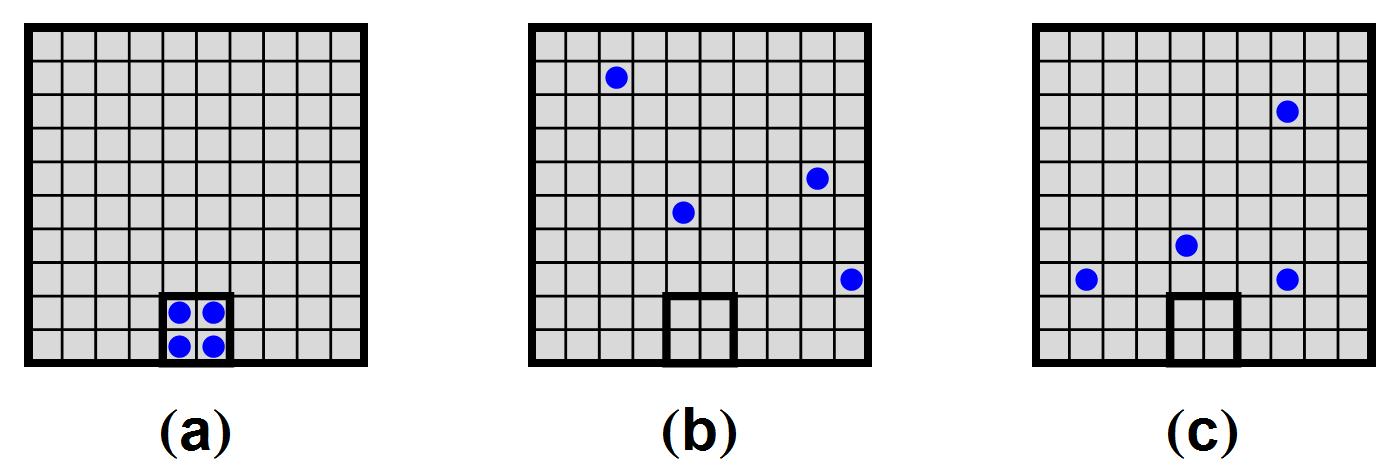
Afbeelding 2. Een eenvoudig model van een leegstromende gasflesSituatie (a) is in dit model de enige microscopische configuratie die overeenkomt met de macroscopische toestand “alle atomen in de gasfles”. Situaties (b) en (c) zijn twee van de vele situaties die overeenkomen met de macroscopische toestand “alle atomen buiten de gasfles”. De toestand “alle atomen buiten de gasfles” heeft dus een veel grotere entropie, en is daarmee als eindsituatie veel waarschijnlijker.
Het begrip entropie is een nuttig hulpmiddel in de macroscopische beschrijving van allerlei thermodynamische processen. Het blijkt echter dat het begrip een nog veel fundamentelere rol speelt in de natuurkunde; een rol die we ontdekken zodra we nadenken over entropie en de richting van de tijd, of over de rol die entropie speelt in de natuurkunde van zwarte gaten.
In dit dossier wordt op al deze onderwerpen uitgebreid ingegaan. Rechts bovenaan deze pagina vind je een overzicht van de artikelen in dit dossier. Je kunt ook direct beginnen met het lezen van het eerste artikel, waarin het begrip entropie nader wordt uitgelegd.